
开发基于天然生物活性羟基酸的治疗型聚酯
我们提出从天然中草药提取物中选择具有明确化学结构的羟基酸来制备治疗型聚酯的思路,旨在突破目前聚酯药物载体无治疗功能的局限。利用广泛存在于中草药植物中的具有生物活性的羟基酸单体进行缩聚反应,我们成功制备出一系列具有治疗功能的聚酯类药物载体材料(图1),其在具备良好生物安全性及高效载药释药能力的同时,突破了现有药物载体无治疗功效的重大局限,有望推动中草药基生物材料及肿瘤治疗取得重大进展。

主要成果:
- 1) 基于阿魏酸的治疗型聚酯作为药物载体
我们首次利用阿魏酸(一种在阿魏、当归、川芎等中药广泛存在的生物活性小分子)作为羟基酸单体,通过缩聚反应将其聚合成聚阿魏酸。制备的聚阿魏酸可自组装为安全无毒的纳米颗粒,作为优良的药物载体负载多种难溶小分子抗癌药物,并能有效靶向递送药物到肿瘤部位,同时聚合物载体自身也可有效抑制肿瘤(图2)。该工作首次实现了中草药聚合物的概念,而且载体自身具有额外的抗肿瘤效果,达到了载体材料也是药的效果,为中草药基生物材料的研发提供了新思路。(Adv. Funct. Mater., 2019, 1808646) (Adv. Funct. Mater., 2019, 1808646)

- 2) 基于熊果酸的治疗型聚酯作为药物载体
基于聚阿魏酸的研究成果,我们进一步以熊果酸(一种广泛分布于夏枯草、铁冬青等中草药中的天然活性成分)为重复结构单元,通过缩聚方法合成了聚熊果酸。聚熊果酸可自组装成纳米载体颗粒,并有效负载递送药物,对于多种肿瘤均具有显著的治疗效果,同时聚熊果酸载体颗粒本身也显示了额外的肿瘤治疗效果(图3)。(Adv. Funct. Mater., 2020, 1907857) (Adv. Funct. Mater., 2020, 1907857)
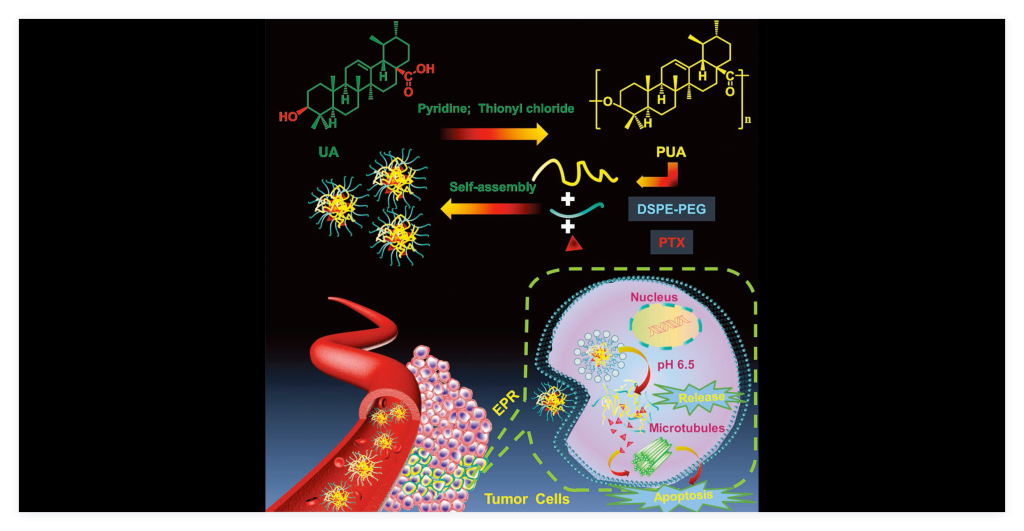
- 3) 基于水杨酸的治疗型聚酯作为药物载体
水杨酸是著名药物阿司匹林的功能活性成分。我们以水杨酸为单体通过缩聚反应制备了聚水杨酸,进而自组装成纳米载体用于药物递送(图4)。聚水杨酸纳米载体高效靶向递送药物,富集药物到肿瘤部位,而且聚水杨酸纳米载体本身也能显著地抑制肿瘤生长。因此,该体系成功地将治疗型聚酯体系从传统中草药体系拓展到中西药结合体系,进一步为治疗型生物材料的研发提供了思路。(Adv. Funct. Mater., 2021, 2100805) (Adv. Funct. Mater., 2021, 2100805)

基于氨基酸的治疗型生物材料
吴钧课题组开发出一系列基于天然氨基酸的聚合物,系统探索了此类聚合物作为缓控释药物载体的构效关系,突破目前大部分药物递送载体在高载药能力及可控递送释放方面欠缺的局限,为发展新型缓控释药物递送载体奠定了研究基础。该氨基酸类生物材料可自身调控代谢途径治疗多种疾病,同时能对药物高效装载,靶向递送及缓控释放,实现高效安全的治疗。
主要成果
- 1)苯丙氨酸/亮氨酸药物递送平台
通过缩聚反应制备的疏水性L-苯丙氨酸聚合物(Phe-PEA)可作为难溶解小分子药物递送平台。该苯丙氨酸聚合物通过自组装形成纳米尺寸的药物载体后,可对多种难溶小分子药物进行有效装载(图1)。吴钧课题组发现当Phe-PEA纳米载体负载了阿霉素后,在急性淋巴白血病的治疗中,能高效靶向骨髓以及白血病细胞,递送释放药物,同时载体自身能通过代谢途径解除免疫抑制,重新激活免疫细胞,自身即可抑制白血病,达到材料也是药物的效果。该研究为首次利用氨基酸聚合物调控代谢进行疾病治疗(Adv. Sci., 2022, 2104134)。申请人以此研究为基础进一步研究发现亮氨酸聚合物载体可激活mTOR信号通路抑制细胞自噬,进而增强化疗药物对耐药白血病干细胞的杀伤作用。装载化疗药物阿霉素的亮氨酸聚合物纳米颗粒能有效清除耐药白血病细胞,有望成为一种靶向细胞代谢的新型白血病治疗药物 (Haematologica, 2022, 107, 2344-2355)。

- 2)l -半胱氨酸基聚二硫酰胺(Cys-PDSA)聚合物
为实现对药物的可控释放,吴钧课题组将L-胱氨酸酯和脂肪二酸或衍生物通过缩聚反应制备成聚合物,构建了还原响应型L-半胱氨酸基聚二硫酰胺(Cys-PDSA)聚合物库。该类聚合物可自组装形成具有高载药能力的纳米载体,并对肿瘤微环境中GSH等产生特异性响应,快速释放药物,从而显著提高肿瘤靶向性、治疗效果并减少毒副作用(图2)。该递药平台可以实现对铂药的高负载及快速释放,并自身能通过二硫键触发的谷胱甘肽(GSH)消耗清除过程,逆转肿瘤细胞对顺铂类药物的耐药性,同时减轻了顺铂药物的严重副作用(Nano Lett., 2018, 18, 4618-4625)。同时,针对具有干细胞特性的耐药型骨肉瘤,该药物递送平台可共递送难溶性小分子抑制剂Apatinib和GSK-J4,将药物输送至肿瘤微环境,通过GSH诱导小分子药物的快速释放,加上载体自身可诱导内质网凋亡,实现对具有干性的骨肉瘤的联合增强治疗效果。该体系能极大地促进联合药物药效,为干性特征肿瘤的治疗提供新思路(Signal Transduct. Target. Ther.,2020, 5(1), 196)。此外,在最新一项工作中,吴钧团队发现胱氨酸聚合物自身不光可以清除GSH,而且能抑制GPX4。该递药平台在递送紫杉醇的同时,选择性诱导白血病干细胞的铁凋亡,在保留正常造血干细胞的前提下,有效改善紫杉醇引起的骨髓抑制等毒副作用,实现对急性髓系白血病的增强治疗(ACS Nano, 2023, 17, 4, 3334–3345)。

- 3) 聚法美仑药物递送平台
吴钧团队还将具有氨基酸结构的临床药物美法仑一步合成制备出聚(美法仑)。聚(美法仑)纳米颗粒可有效抑制细胞增殖并诱导细胞凋亡,显示了比临床美法仑制剂更好的肿瘤富集以及抑瘤效果(图3)。该体系代表了一种新型的肽合成策略和纳米平台。(Nano Today,2021,37,101098)。

药食同源的治疗型生物材料
利用药食同源理念和低碳策略,将食物直接使用或者经过简单处理,结合3D支架材料技术,构建的新型生物材料可促进组织和器官再生。
将传统豆腐制备工艺进行简单改良后用于豆腐支架的开发,有效避免了有毒试剂的引入,极大提升了支架材料的生物安全性。最终对于早期成骨、骨再生和免疫因子的释放具有良好的促进作用。(ACS Biomater. Sci. Eng. 2020, 6, 5, 3037–3045)
