
构建spike蛋白翻译后修饰图谱并揭秘其对三维结构和功能的影响

为阐明PTM在SARS-CoV-2 spike蛋白的结构和毒力中的作用,研究首先基于LC-MS/MS技术绘制了spike蛋白PTM的高分辨率图谱。
其次,基于诱变的方法,以一种氨基酸取代翻译后修饰的氨基酸,以模拟交替的物理化学特征,重建了由PTM引起的spike蛋白结构异质性。
最后,研究评估了spike蛋白高度修饰的RBD区域及其与受体蛋白ACE2的相互作用,以揭示其结合强度。
该研究为spike蛋白结构分析和设计更有效的新冠治疗方法提供了新的科学见解。研究工作流程如图1所示。
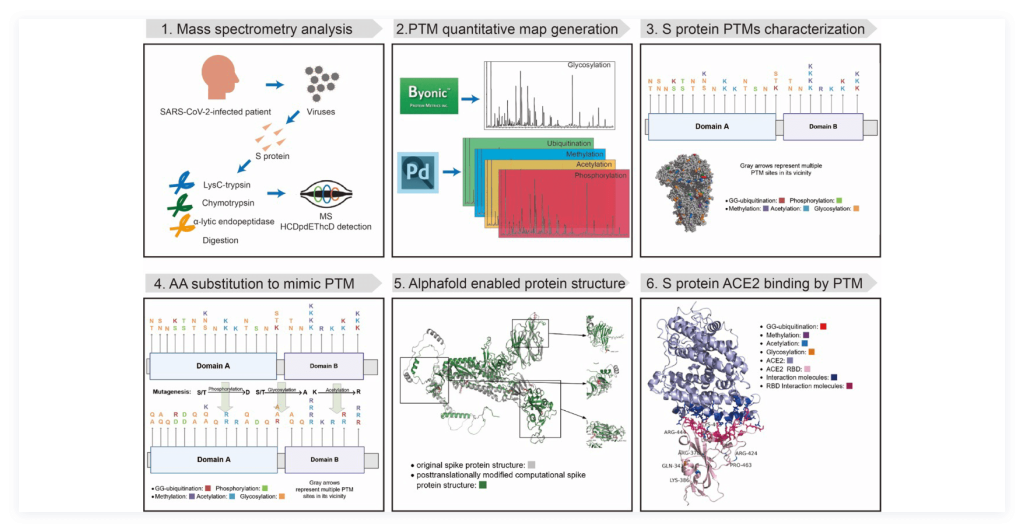
1) 该研究首次利用LC-MS/MS数据绘制了全面的SARS-CoV-2 spike的高分辨率定量PTM图谱,以阐明全面的PTM位点,发掘出包括磷酸化、乙酰化、甲基化、泛素化和糖基化等共计87个PTM位点。其中,在RBD区域确定了14个PTM位点。

2) 同时,研究表明,PTM的发生频率对于理解其作用机制至关重要,尽管大多数PTM位点(67个)被单一类型的PTM修饰(糖基化),但其余的PTM位点(20个),如378K,被乙酰化修饰。
以上结果表明,对PTM的全面表征可以呈现spike蛋白的翻译后修饰特征,进而有利于深入了解病毒的毒力和感染性的机制。
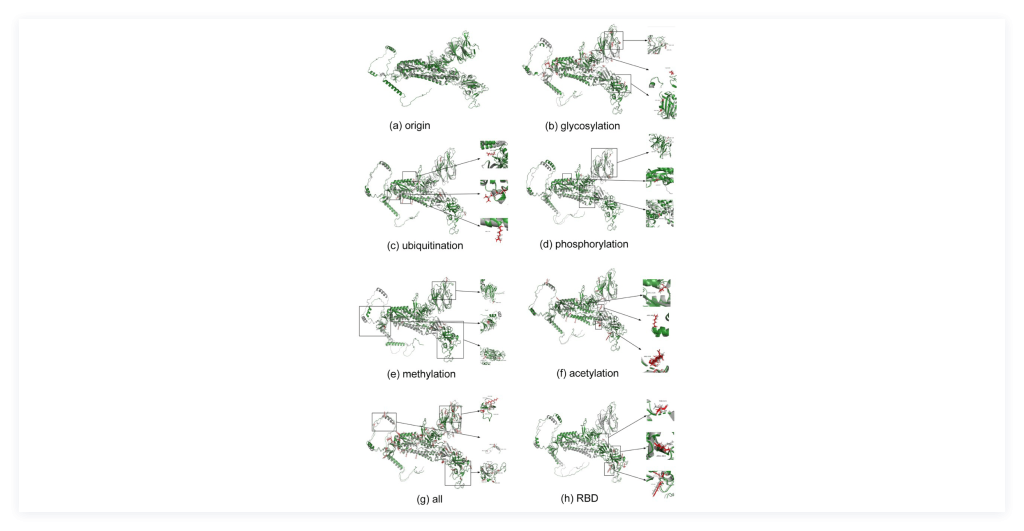
研究进一步基于诱变的方法,以一种氨基酸取代PTM修饰的氨基酸,从而模拟替代修饰所带来的物理化学的变化,并根据替换后的序列预测spike蛋白的结构,重建了由PTM引起的spike蛋白结构异质性。
为评估和验证该方法的准确性,研究者将预测的结构与冷冻电镜的实验所得到的结构进行比对,以比较结果的相似性和差异。同时,为分析不同的PTM对spike蛋白结构的影响,研究者通过单一氨基酸诱变来评估具体PTM修饰类型的影响,并发现甲基化和乙酰化对spike蛋白结构影响最为深刻。
3) 最后,为评估因PTM修饰导致的spike蛋白功能的变化,研究者系统地计算了spike蛋白和宿主因子(ACE2,ASGR1和KREMEN1)复合物残基的极性、亲水特性和带电特性,进而分析其结合的相互作用。
研究结果表明,PTM导致spike蛋白与宿主因子的相互作用位点发生深刻的变化,其中甲基化修饰的spike蛋白与ACE2宿主因子的结合力最高。该结果可对因PTM影响的蛋白质结构和功能提供启示,并有助于药物发现、抗体设计和SARS-CoV-2感染的有效治疗。
综上所述——
首先,该研究在SARS-CoV-2 spike蛋白中鉴定到87个PTM位点。随后,提出并验证了一种基于诱变的计算方法,预测因PTM导致的spike蛋白结构改变,并发现不同的PTM类型对蛋白质结构变化的影响不同,甲基化影响最大,泛素化影响最小。最后,分析了SARS-CoV-2 spike蛋白与其受体蛋白ACE2、ASGR1、KREMEN1的结合力和分子间相互作用,证明了PTM能够显著影响spike蛋白与宿主因子的相互作用。在缺乏昂贵且高效的方法来表征由PTMs引起的蛋白质结构变化的情况下,该研究提出的创新计算算法可为蛋白质结构表征和功能研究找到有效的途径。